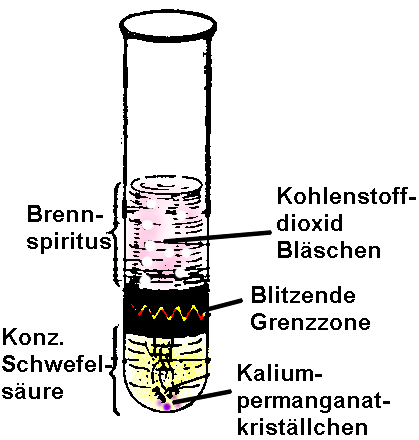
a) Durchführung:
 |
Ein Reagenzglas wird an einem Stativ senkrecht eingespannt und evtl. bis zur Hälfte in (Kühl-) Wasser getaucht. Das Reagenzglas wird dann 2 Zentimeter hoch mit konzentrierter Schwefelsäure gefüllt, wobei zu beachten ist, daß die obere Gefäßwand nicht mit der Säure in Berührung kommt. (Achtung: Verätzungsgefahr) Danach füllt man vorsichtig mit einer Pipette eine etwa 4 Zentimeter hohe Schicht Brennspiritus auf, wobei man die Pipettenmündung nur wenige Millimeter über die Schwefelsäure hält, damit sich die Flüssigkeiten nicht vermischen (Achtung: Bei der Vermischung tritt sonst eine gefährliche Wärmeentwicklung auf, wodurch Flüssigkeit aus dem Reagenzglas hinausgeschleudert werden könnte.). Nun werden kleine Kaliumpermanganatkristalle (Masse: >50 Milligramm) in das Reagenzglas geworfen. |
b) Beobachtung:
| An der Grenzfläche zwischen den beiden Flüssigkeiten bilden sich unter Knistern Funken. Es tritt eine grünliche Färbung der Schwefelsäure auf. Das Blitzen dauert etwa ¼ Stunde, wobei die Reaktion durch Hinzuwerfen von Kaliumpermanganat verlängert werden kann. Wichtig: Zum Schluß muß der Inhalt des Reagenzglases mit abgewandtem Gesicht in Wasser gegossen werden, um Überhitzung zu vermeiden. | |
| links: abgedunkelt; rechts: beleuchtet |
c) Auswertung:
Die Flüssigkeiten vermischen sich nicht, da Schwefelsäure eine Dichte von 1,8 g cm-3 und Brennspiritus von 0,8 g cm-3 hat. Die Kaliumpermanganatkriställchen bilden mit der Schwefelsäure grünliches Dimanganheptoxid Mn2O7, welches zum Teil nach folgenden Gleichungen zerfällt:
2Mn2O7®4MnO2 + 3O2 bzw. 2Mn2O7® 4MnO2 + 2O3.
Der aus dem Manganheptoxid
frei gesetzte Sauerstoff oxidiert den Brennspiritus an der Grenzfläche
beider Flüssigkeiten unter leichten Feuererscheinungen zu Kohlendioxid
und Wasser. Das Kohlendioxid sieht man nach jedem Funken in Form von Gasbläschen
durch den Brennspiritus aufsteigen, während das beim Zerfall des Heptoxids
gleichzeitig entstehende Mangandioxid (Braunstein!) an der Grenzfläche
in Gestalt von braunen Wolken zu erkennen ist. Weitere Informationen verbergen
sich hinter diesem
Link.
[zurück]
Quellen:
http://www.ph-heidelberg.de/org/chemie/
Römpp / Raaf, Chemische Experimente mit einfachen Mitteln, München 1974